Периодическая система химических элементов
Содержание
В России было множество выдающихся открытий и исследователей в различных отраслях науки. Наиболее весомым вкладом российских ученых в физику и химию стала периодическая таблица Менделеева.
В течение многих десятков лет ученые со всего мира предпринимали попытки создания классификации, способной объединить вещества по схожести состава и параметров образованных соединений. Предлагаемые схемы не позволяли эффективно решить поставленную задачу.
Д.И. Менделеев много лет проводил детальный сбор и классификацию данных о свойствах элементов. Теория всегда подтверждалась путем практических экспериментов. Данные о каждом компоненте заносились ученым на информационные карточки.
С их помощью химик пытался создать последовательную логическую схему. Длительные и кропотливые исследования привели ученого к умозаключению, что характеристики компонентов и их соединений варьируются с увеличением веса атома периодически.
Таким образом, профессор сделал весомое изобретение — периодический закон. Формулировка основного закона физики была четко и достоверно проиллюстрирована профессором в периодической системе Менделеева.

Какая структура таблицы Менделеева по химии
Один из самых легких вопросов в экзаменационном билете ЕГЭ — сколько элементов в таблице Менделеева.
Изначально, система вмещала 63 химических компонента. Дополнительно, физик оставил в ней свободное пространство для новых еще не открытых элементов. При этом он детально указал их характеристики.
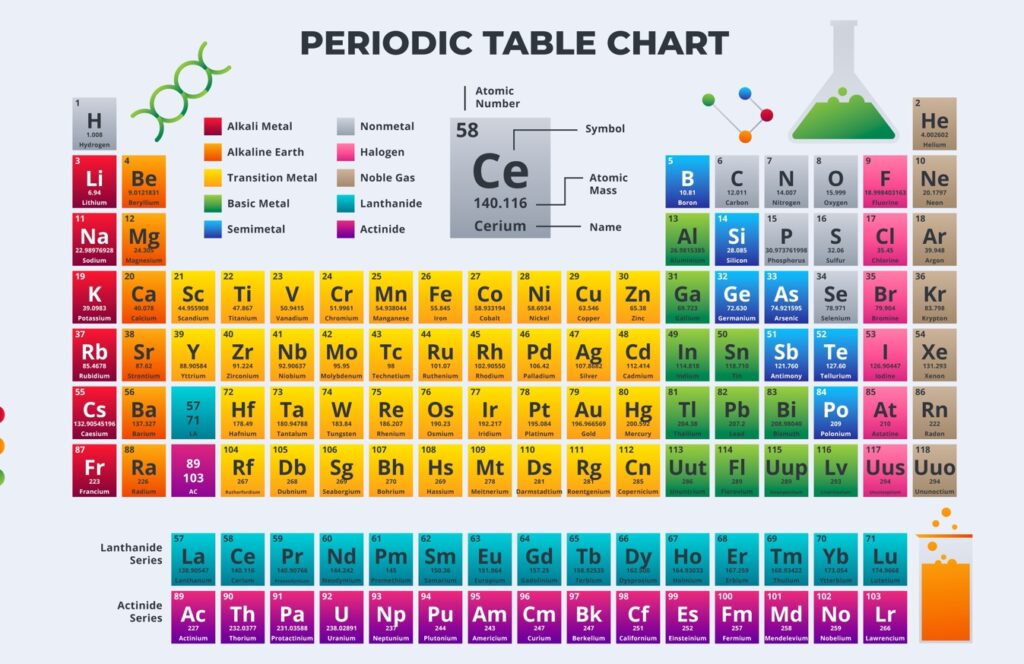
Сейчас в матрице содержится 118 веществ. Каждому, из них предопределено собственное место с учетом имеющегося атомного радиуса в таблице Менделеева. Он отображает, какое количество протонов содержится в ядре и сколько электронов расположено около него. Наблюдается последовательное увеличение протонов в каждом следующем веществе на одну единицу.
Периоды — 7 строк матрицы. В них входят вещества с равным числом, заполненных электронами энергетических уровней.
Под группами понимаются столбцы. Они объединяют вещества с единым числом частиц на наружном энерго уровне атомов. В сокращенном формате таблицы Менделеева в ЕГЭ они разделены на 8 столбцов.
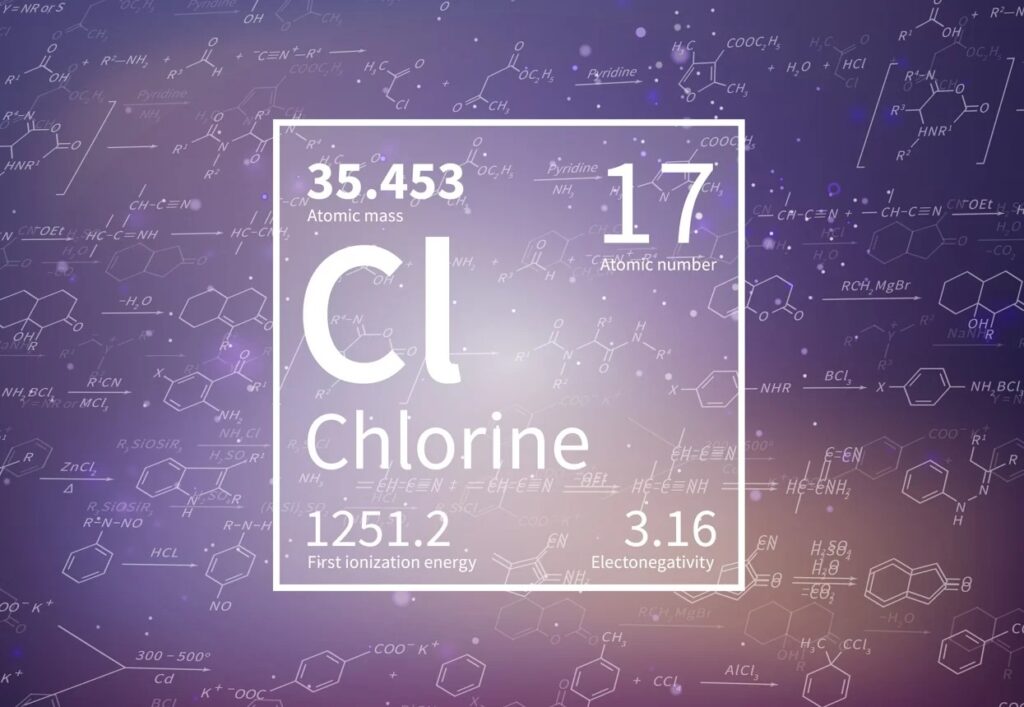
В качестве обозначения химических компонентов используются латинские символы. Порядковый номер химического элемента показывает количество протонов в ядре. Он отображается в левом углу сверху. В ячейке указывается относительный атомный вес вещества.
Расчет количества нейтронов в ядре вещества происходит путем вычитания идентификационного номера из массового числа.
Основные свойства в таблице Менделеева
При подготовке к экзамену необходимо выучить, что такое химический элемент, его виды и основные химические параметры.
Как характеристики варьируются в столбцах:
- Металлические характеристики увеличиваются, неметаллические — становятся слабее.
- Повышается число атома.
- Возрастают базовые параметры гидроксидов, кислотные характеристики водородных соединений неметаллов.
Как изменяются качества элементов в строках:
- Характеристики металлов ослабевают, а неметаллические — становятся сильнее.
- Снижается радиус атома.
- Повышается электрическая отрицательность.

Элементы таблицы Менделеева в ОГЭ по химии
Обязательно запомните, как расположены металлы и неметаллы в таблице Менделеева.
Расположение химического вещества в строке матрицы дает возможность узнать принадлежность. Неметаллы находятся в верхнем углу справа, а металлы — снизу в левом углу. По центру расположены полуметаллы. Все строки, за исключением первой, начинаются щелочным металлом. В конце каждого находится инертный газ.
Один из самых распространенных вопросов в экзаменационных билетах: в каком ряду представлены простые вещества металлы. Они находятся в главных (А) и побочных (Б) группах.
Более углубленное изучение темы происходит в формате теоретических и практических занятий с педагогом в образовательном центре «TWOSTU». В процессе подготовки к ЕГЭ преподаватели предлагают учащимся наглядные примеры и схемы для понимания и лучшего усвоения учебного материала.
При грамотном подходе к обучению периодическая таблица Менделеева надолго останется в памяти учащегося.
