Что нужно знать, чтобы хорошо сдать ОГЭ по химии в 9 классе?

Содержание
ОГЭ по химии является одним из самых сложных экзаменов в школе. Для успешной сдачи экзамена не достаточно заучивания, как в литературе или истории. Химию следует учиться понимать.
В отличии от ЕГЭ, ОГЭ по химии не требует узких знаний и умений.
Чтобы удачно сдать предмет хватит и уметь пользоваться базой. Для качественной подготовки рекомендуется проработать не менее 30 вариантов экзамена.

Какие задания присутствуют в ОГЭ по химии?
Вариант ОГЭ состоит из 24 заданий. Условно его можно разделить на 3 части.
- первая часть состоит из 17 тестовых заданий;
- во второй части номера 18,19 содержат задачи, где требуется написать только числовой ответ;
- в третью часть входят задачи с химическими реакциями с 20 по 24. В них предлагают дать развернутый ответ, прописать все этапы решения и итоговый ответ.
Разбор заданий ОГЭ по химии
- 1 задание
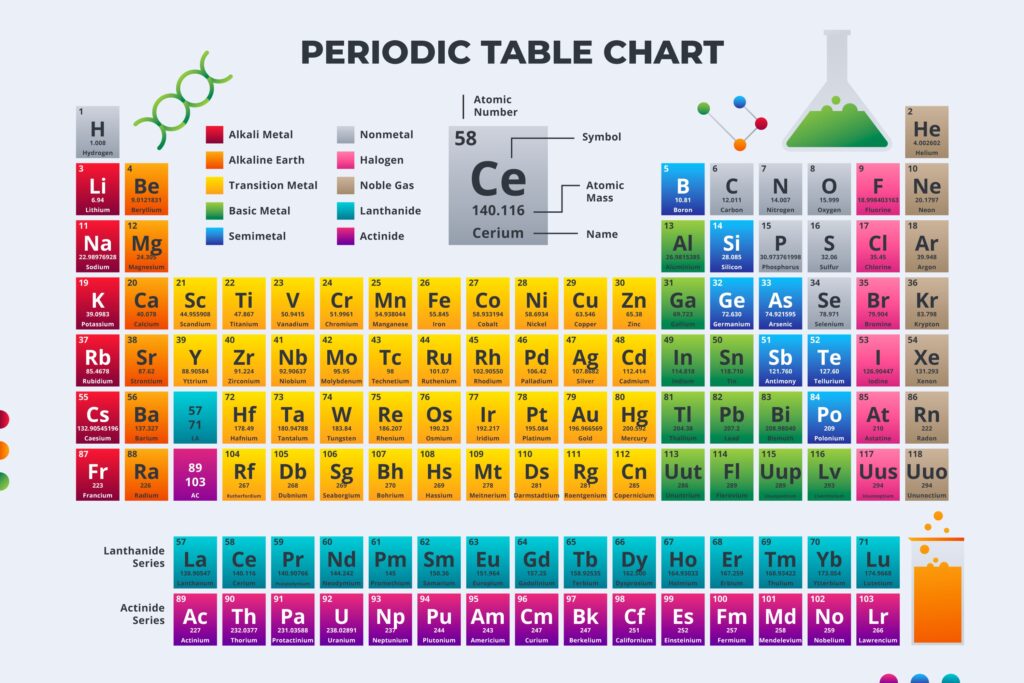
Чтобы решить 1 задание и 16, достаточно знать, что из себя представляет элемент и его краткую характеристику. В ответ записать один или два правильных высказывания об элементе. Для решения следующих трех номеров и 6 понадобится таблица Менделеева.
Следует пользоваться правилом: слева направо неметаллические свойства в периодах усиливаются, радиус уменьшается, электроотрицательность возрастает. Сверху вниз эти характеристики противоположны.
Таблицы в приложении к бланку-это первые помощники, с помощью которых можно решить половину экзамена.
- 5 задание
Задание 5 просит простого знания. Решить его можно быстро, всего лишь прочитав пару страниц учебника о химических связях. Чтобы точно не ошибиться, важно запомнить, что ионная связь образуется между типичными металлами и неметаллами с большой разностью электроотрицательности.
Например, как у хлорида бария. Ковалентная связь будет у газов и простых соединений, наподобие воды, соляной кислоты.
- 7 задание
Номер 7 сможет решить любой троечник. Это может быть выбор сложного из простого, основного или кислотного оксида или указание правильных названий формулы.
Для этого требуется знание характеристики элемента, а если вспомнить сложно, можно посмотреть в таблицу.
Задания повышенной сложности
Начиная с 8 примера уровень сложности повышается. Номера 8,9,10 содержат химические реакции. Здесь не обойтись простым заучиванием, поэтому если есть пробелы хотя бы в одной теме, то по итогу может посыпаться весь экзамен. В таких случаях мы рекомендуем начать подготовку к экзамену заранее и записаться на курсы подготовки к ОГЭ по химии в Москве.
Не обязательно знать, с чем реагируют сложные соли и какие 10 продуктов образуется в результате. В варианте будут только два простых продукта. Чтобы решить их правильно, важно запомнить с чем реагируют кислоты и щелочи, что получится в итоге.
Например:
- кислота+щелочь=соль+вода.
Для каждой реакции существует такая короткая схема. При решении нескольких примеров данная закономерность быстро запоминается.
В 11,12,13,14 проверяются знания на продукты, которые образуются в результате связи веществ, умения их распознавать.
Если есть подозрение на выпадение осадка или растворения, можно проверить предположения, посмотрев в таблицу растворимости. Р-вещество в воде растворимо, Н-будет осадок. Цвета осадков, газов придется заучить, но их не слишком много.
Задание 15 всегда содержит готовую окислительно-восстановительную реакцию. Цель: определить, что есть окислитель, а что восстановитель. Можно даже не проставлять степень окисления для выявления правильного ответа.
Достаточно заметить, что восстановителями могут быть бескислородные кислоты и гидроксиды активных металлов. 20 такое же, как 15, только дополнительно указывают расписать коэффициенты.
В 17 предлагают выбрать типичный реактив-различитель. Если возникают трудности с выбором правильного варианта, то можно снова обратиться к таблице растворимости. Реактив будет подобран правильно, если в результате смешивания выпадет осадок или образуется газ. Таким методом можно пользоваться и при решении 20 номера.
В 18,19,22 простые задачи на выявление массовой доли элемента и количества вещества в граммах. Массовую долю находят по известной схеме: сложить все молекулярные массы элементов, далее выявить процент содержание нужного через простую пропорцию на проценты.
Молекулярную массу можно каждого элемента посмотреть в таблице Менделеева. В 24 иногда бывает подвох, когда в результате преобразований получается не 2, а 3 продукта.
